
[疫学レクチャー第5回] 疫学メタ解析のよみかた

規模を大きくして層別化解析を行う
疫学(観察)研究の分野でメタ解析が求められる理由は,おもに2つあります。
まず,既存の研究では規模が不十分な場合。たとえばわが国では冠動脈疾患の発症率が欧米にくらべて低く,単独の地域コホート研究では性・年齢層ごとに危険因子とリスクとの関連を明らかにするのは困難ですが,そのためにわざわざ,新たな大規模コホート研究を立ち上げるのは大変です。そこで複数のコホート研究を集めてメタ解析を行えば,細かい層別化をしたうえでも精度を保った解析が可能になります。とくに循環器疾患の分野では,性,年齢,そして喫煙などの併存する要因によって,危険因子と疾患リスクとの関連が異なることがよくあるため,メタ解析によって詳細な層別化解析を行うことができれば大変有益です。
もう1つは,これまでの研究で結果が一致していない課題の検証です。複数の研究のあいだで結果が異なるような場合,その背景には,危険因子の分布の違い,民族・人種・地域差,あるいは見ようとしている関連がそれほど強くないなど,いろいろな可能性があります。そこで,さまざまなコホート研究のデータを集めてメタ解析を行うことで,真の関連を明らかにしようというわけです。
文献ベースのメタ解析には,異質性とバイアスによる限界がある
医学の分野でメタ解析が行われるようになったのは1980年代ごろからで,最初に確立されたのは,同じ仮説を検討している複数の研究の公表済みデータを集めて解析するという,いわゆる文献ベースのメタ解析の手法でした。とくにランダム化比較試験のメタ解析が,今日の多くの診療ガイドラインで高いエビデンスレベルを与えられているのはご存知のとおりです。
複数の研究を集めてくると,当然のことながら,対象者の年齢や危険因子の分布はそれぞれ異なっています。もちろんその影響をなるべく除外しようと,各研究でも調整を行ったうえで結果を算出しているわけですが,その調整に用いる統計的手法や,調整に用いる因子も,研究によってばらばらです。そうすると,データをまとめること自体は可能でも,異質なもの同士をまとめている可能性を否定できない。これが文献ベースのメタ解析の限界です。公表されているデータしか解析できないという出版バイアスの問題もあります。
また疫学研究の場合,コホートごとに調査方法や測定項目のカットオフ値が異なることが多く,メタ解析を行う際にはこれが大きな壁となります。たとえばベースライン時の血圧ひとつとっても,1回だけ測定した値なのか,2回測定した値の平均なのか,測定は水銀血圧計なのか,自動血圧計なのか。あるいは自己記入式の質問票で高血圧既往の有無をたずねているだけかもしれません。その結果からカテゴリーを設定するときにも,既存の診断基準値を用いる,四分位数を用いるなど複数の方法があります。これらの違いからさまざまなバイアスが入り込む可能性があるため,疫学の場合は,研究同士をくらべられるようにすること自体が大変難しいのです。
適切な手法を用いなければ,誤った結論が導き出される場合も
異質かもしれない研究結果をまとめて解析するということについて,もう少しくわしく説明しましょう。コホート研究Aにおいて,ある危険因子の値が高いほど循環器疾患の発症率が上がるという,正の関連がみられたとします(図1)。
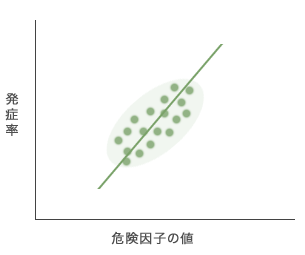
図1 コホート研究Aから得られた,危険因子と疾患発症率との正の関連(模式図)
次に,同様の検討を行っている別のコホート研究B,Cを集めてきたとします(図2)。BではAと同じ正の関連がありますが,Cでは明らかな関連はみられていません。
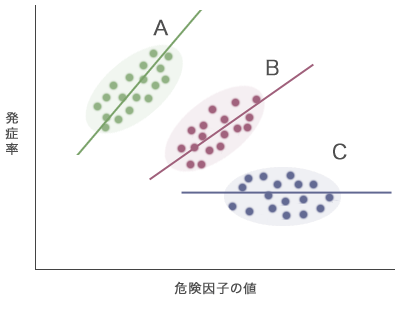
図2 コホート研究A~Cから得られた,危険因子と疾患発症率との関連(模式図)
メタ解析でデータをまとめる際は,まずは各コホートでの分析結果をみて,AとBのように同じ傾向であれば,調整のためにコホートの識別変数(A=0,B=1)を設けたうえで,統合解析を行います。しかし,コホートAとCでは結果の傾向が異なっているため(これを「コホートによる交互作用がある」といいます),コホートの識別変数だけではなく,交互作用項の変数を統計モデルに加えなければなりません。これをせずにA~Cを単純にメタ解析してしまうと,個々の研究では正の関連,ないしは関連せずという結果であるにもかかわらず,全体としては「危険因子と疾患との関連は負」という,正反対の結果が出てしまいます(図3)。
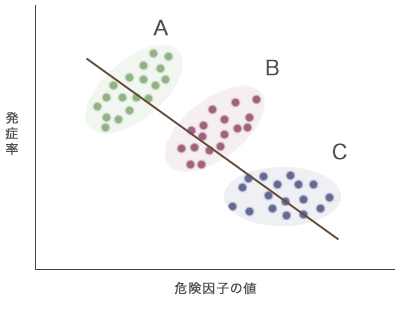
図3 コホート研究A~Cの交互作用を考慮せずにメタ解析した結果(模式図)
これは極端な例ですが,適切な手法を用いなければ,メタ解析が誤った結論を導き出しうることは,おわかりいただけるでしょう。
2011年にJAMA誌に発表されたJ. Staessen氏のグループによる文献では,塩分摂取量が少ないと心血管疾患死亡率が上昇するという結果が注目を集めました1)。ここではFLEMENGHO研究(登録: 1985~90年)とEPOGH研究(1999~2001年)の2つをまとめた解析が行われていますが,前者は農村住民からの無作為抽出,後者は欧州6か国の高血圧外来受診者からの家族単位での無作為抽出で,登録年数にも約10年の開きがあります。さらに前者では,後者よりも蓄尿でみた塩分摂取量が少ない一方で心血管イベント発生率が高かった。いわば上記のコホートAとCをまとめた結果,図3と同様の結論が導き出されてしまった状況といえます。塩分摂取量と心血管疾患との関連を検討している数多くの観察研究のなかから,このように互いに性質がかなり異なる2つのコホート研究をわざわざ取り出してきてまとめる必然性が,はたしてあったのでしょうか。別々に解析すれば,あるいは適切なメタ解析の手法を用いていれば,結論は異なっているはずです。
メタ解析を行う際は,検証したい仮説を明確に定め,そのためにどういう手法を用いたのかを明らかにしなければなりません。文献ベースのメタ解析ならば,仮説の検証のために必要な文献を,客観的な基準をもって適切に選択することが求められます。そうでなければ,「結論ありき」で含める文献を恣意的に選び,結果にはバイアスがかかっているといわれても,文句はいえません。
結果を読むほうの立場からは,自分の求める情報が含まれるメタ解析かどうかの判断のためにも,その検討が行われた目的,および文献の選択基準が明確に示されているかどうかをきちんと確認することをすすめます。
個人ベースのメタ解析: 「生データ」に立ち戻ることで質の高い解析が可能に
文献ベースのメタ解析の限界を補うことができるのが,Petoらによって1990年代から行われるようになった,個人をベースとしたメタ解析です2)。研究単位ではなく,各研究が有する個人単位の「生データ」を集めてくる方法で,文献ベースのメタ解析との区別のために「pooled analysis」「統合解析」などとよばれることもあります。
文献ベースのメタ解析の場合,各研究ですでに交絡因子が調整され,公表されているデータを,あとから調整前のデータに戻すことはできません。一方,個人レベルのデータにまで立ち戻れば,同じ統計学的手法を用いた均質な「再調整」が可能になるため,バイアスが少なく,交絡因子も調整した,質の高いメタ解析を行うことができます。各研究の出発点はばらばらなので,調査手法の違いは依然として存在していますが,その調整を行う際の自由度が高い方法といえるでしょう。もちろん,先の項でStaessen氏らの文献に関して指摘したように,個人のデータを調整して分析しても,分析のしかたによっては,依然,問題点が生じる可能性がありますので,注意が必要です。
個人ベースのメタ解析の短所は,各コホート研究から直接未発表データを入手しなければならない点です。手間も時間もかかりますし,各コホート研究が蓄積してきた貴重なデータを出してもらうわけですから,そのための交渉や,情報のセキュリティも含めた研究体制の整備が必要になります。もともと信頼関係があるような場合は,各コホートの研究者に依頼して無記名化データを直接提供してもらいますが,それが難しい場合,依頼側が示す手法に従って受ける側がデータの分析をして,依頼側はその結果だけを受け取るというケースもあります。
国際電話でいきなりデータ提供依頼
統合解析の例として,これまでに,Prospective Cohort Studies Collaboration(PSC)1)やAsia Pacific Cohort Studies Collaboration(APCSC: APCSCの紹介ページへ)などがあり,いずれも日本のコホートが含まれています。
APCSCのときには,初代の主任研究者であるシドニー大学のStephen McMahon氏から,突然,私に国際電話がかかってきました。過去にも国際高血圧学会などで交流のある関係ではありましたが,電話で直接データの提供を依頼されたときには驚きました。さらには,私が携わっているコホートだけでなく,日本のほかのコホートのデータも集めて提供してほしいというのです。しかし,疫学研究は地域に根ざし,住民の方々との信頼関係のもとで地道に行われてきたものが多く,そうして長年積み重ねてきたデータをほかの研究者に渡すというのは大変なことです。おいそれと承諾はできません。
そこで私は,解析結果を文献として発表するときに,参加コホート名や研究者名を明記すること,そして著者を執筆者の個人名ではなく研究グループ名(APCSC)にすることを協力の条件とすることにしました。また,日本人研究者が,データを提供するだけではなく自らもAPCSC全体のデータにアクセスし,それを解析すれば新たに論文を執筆することも可能となるような体制を整えたうえで,国内の研究者に広く参加を呼びかけたのです。その結果,日本からは12研究が参加することになりました。なお,成果の発表が軌道に乗ったこともあり,最近のAPCSCの論文では筆頭著者の個人名を入れるようになりました。
また,こうした国際共同研究の経験も活かして立ち上げられたのが,本邦で行われてきた複数のコホート研究のメタ解析であるJALS(JALSへ)とEPOCH-JAPANです。
あらかじめプロトコルを標準化して行う「前向き」メタ解析
さらにバイアスの少ない方法もあります。メタ解析と聞いてみなさんが想像するものとはすこし違うかもしれませんが,「前向きに計画されたメタ解析」です。
その一例であるINTERSALT(INTERSALTへ)は,世界32か国の52コホートのデータを集めた研究で,塩分摂取量と血圧値との関連をコホートごとに検討したうえで,その結果を統計学的手法により統合するというメタ解析の手法を用いていますが,基本的に「後ろ向き解析」となる通常のメタ解析とは異なり,研究開始時に,あらかじめ全コホートで調査のプロトコルを標準化しておくのです。血圧計も問診票も24時間蓄尿の方法も,すべて32か国で同一です。問診票については,オリジナルの英語版から各国の言語に翻訳したのち,再度英語に翻訳し直して意味が合致するかの確認まで念入りに行い,可能なかぎりバイアスを避けています。
「前向きのメタ解析」としてはわが国でも,主要なコホート研究を個人ベースで統合しているJALS(統合研究)があります。各コホートの研究者が集結して会議を何度も重ね,研究デザイン,調査方法,データ収集方法などの厳密な標準化を行っていることが大きな特徴です(JALSへ)。たとえば血圧なら,すべてのコホートで「自動血圧計を用い,間をおいて2回測定した値の平均」と統一していますし,問診票もすべて同一のものを用います。このような「前向きのメタ解析」は,標準化のプロセスや,統計専門家の協力も含めた研究体制の整備など,事前の準備が大変ではあるものの,調査手法によるバイアスを最小限におさえることができるため,理想的なメタ解析といってもよいかもしれません(図4)。

図4 いろいろなタイプのデータのまとめかた:従来のレビューからメタ解析まで
疫学のメタ解析結果を読むときのポイント
さいごに,疫学研究のメタ解析の解釈のポイントをまとめておきましょう。
・メタ解析の目的と研究の選択基準を確認する
メタ解析を行う目的,ならびに,そのために適切なデータ収集が行われているかどうかは非常に大切です。研究の組入れ基準が,明確かつ客観的に示されているかどうかも確認してください。
・研究が実施された年代を確認する
各研究の登録年や追跡完了年を必ず確認してください。循環器疾患の危険因子とその重みは,生活習慣の変化や,薬物治療をはじめとした医療技術の進歩などによって経時的に変化します。したがって,実施年に大きなばらつきのある研究をまとめている場合,その解釈は難しくなります。
・集団の特性を読み取り,結果をどう応用できるかを考える
メタ解析の文献には,多くの場合,各研究の主要な対象背景が一覧できる表があります。上記の研究が実施された年代だけでなく,対象者の年齢の幅,男性・女性の割合,地域・人種・民族,また一般住民か外来受診患者かといった項目をチェックし,「ここで集められた対象者は,どのような集団を代表しているのか」という特性を読み取るようにしてください。それによって,得られた結果をどのような人に当てはめることができるかも変わってきます。
研究間の対象背景の違いに対しては統計学的な調整が行われますが,ほんとうに調整できているのかどうかはわかりません。これは臨床試験のメタ解析でも同じです。
・研究の異質性をみる
フォレストプロットなどから,含まれる研究の異質性の度合いを確認します。特定の研究に全体の結果がひっぱられているなど,含まれる研究の異質性が大きい場合,統合解析の結果の信頼性が高いとはいえません。
疫学研究のメタ解析は,単独のコホート研究で生じる対象者の偏りや規模といった限界を補うことのできる,有益な研究手法の一つです。研究デザインや,上に挙げたような解釈のポイントに留意しながら,メタ解析から得られるエビデンスを注意深く吟味し,予防や治療のために適切に活用していただきたいと思います。
- 1) Stolarz-Skrzypek K, et al; European Project on Genes in Hypertension (EPOGH) Investigators. Fatal and nonfatal outcomes, incidence of hypertension, and blood pressure changes in relation to urinary sodium excretion. JAMA. 2011; 305: 1777-85.

- 2) Prospective studies collaboration. Cholesterol, diastolic blood pressure, and stroke: 13,000 strokes in 450,000 people in 45 prospective cohorts. Lancet. 1995; 346: 1647-53.

[訂正] 2015年4月6日,以下の訂正を行いました。
(1) 「適切な手法を用いなければ,誤った結論が導き出される場合も」の,以下の下線部分を削除しました。
「これは極端な例ですが,適切な手法を用いなければ,文献ベースのメタ解析が誤った結論を導き出しうることは,おわかりいただけるでしょう。」
(2) 「個人ベースのメタ解析: 「生データ」に立ち戻ることで質の高い解析が可能に」の,以下の下線部分を削除しました。
「上にあげたような文献ベースのメタ解析の限界を補うことができるのが,Petoらによって1990年代から行われるようになった,個人をベースとしたメタ解析です2)。」
(3) 「個人ベースのメタ解析: 「生データ」に立ち戻ることで質の高い解析が可能に」に,以下の追記を行いました。
「もちろん,先の項でStaessen氏らの文献に関して指摘したように,個人のデータを調整して分析しても,分析のしかたによっては,依然,問題点が生じる可能性がありますので,注意が必要です。 」
■異質性
メタ解析によって,いくつかのコホート研究の結果を要約してまとめようとするとき,検討する危険因子と疾患との関連が,あるコホートでは他のコホートと異なっていることがある。このような場合,このコホートには異質性がみとめられるという。
■バイアス
おもにデータを得る際に生じる偏りのことをいう。たとえば個人の飲酒習慣を調査するとき,問診調査票の項目が,標準化された同一のものでないと,得られた回答には偏りが生じる。血圧の測定でも,測定回数やカフの加圧速度,被験者の姿勢などの測定条件を標準化しておかないと,系統的な誤差(バイアス)が入る。
